La química, la ciencia que estudia la materia y sus propiedades, se basa en la comprensión de las unidades fundamentales que la componen. Una de estas unidades esenciales es el mol, una unidad que representa una cantidad específica de sustancia. Este artículo profundiza en la historia del mol, su definición, aplicaciones y su importancia en el desarrollo de la química moderna.
La Historia del Mol: Un Viaje a Través del Tiempo
El concepto de mol no surgió de la nada. Su desarrollo se basa en una serie de descubrimientos y teorías que revolucionaron la comprensión de la materia.
Los Precursores del Mol: Las Leyes de los Gases
A finales del siglo XVII, Robert Boyle realizó experimentos que demostraron la relación inversa entre el volumen y la presión de un gas a temperatura constante, conocida como la Ley de Boyle. En el siglo XVIII, Jacques Alexandre Charles descubrió que el volumen de un gas a presión constante es directamente proporcional a su temperatura, lo que se conoce como la Ley de Charles.
En 1808, Gay-Lussac publicó su ley, la cual establece que el volumen de un gas a temperatura constante es directamente proporcional a su presión. Estas leyes empíricas sentaron las bases para la comprensión del comportamiento de los gases y la posterior definición del mol.
Avogadro: Un Paso Crucial en la Definición del Mol
En 1811, Amedeo Avogadro propuso una hipótesis que revolucionó la química: volúmenes iguales de gases diferentes, a la misma temperatura y presión, contienen el mismo número de moléculas. Esta hipótesis, conocida como la Ley de Avogadro, estableció una relación directa entre el volumen de un gas y el número de moléculas que contiene.
La ley de Avogadro fue crucial para el desarrollo del concepto de mol. Al establecer una relación entre el volumen de un gas y el número de moléculas, abrió la puerta para la cuantificación de la materia a nivel molecular.
La Constante de Avogadro: Un Número Fundamental
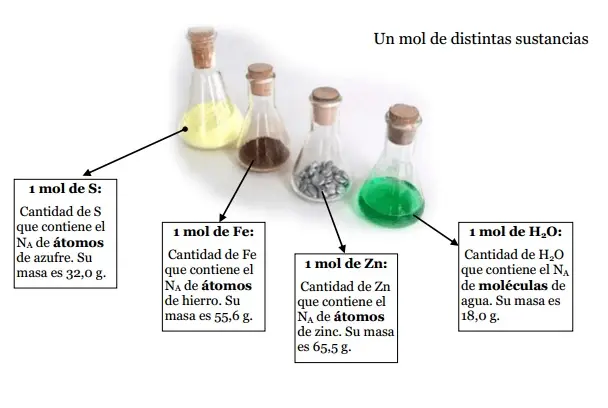
La ley de Avogadro llevó al desarrollo de la constante de Avogadro, que representa el número de entidades elementales (átomos, moléculas, iones) que hay en un mol de sustancia. Esta constante, representada por el símbolo NA, tiene un valor aproximado de 022 x 1023Entidades por mol.
La constante de Avogadro es un número fundamental en química, ya que permite relacionar la cantidad de sustancia en moles con el número de partículas que la componen. Su valor fue determinado a través de diversos experimentos, como el experimento de la gota de aceite de Millikan, que permitió determinar la carga del electrón, y los experimentos de Jean-Baptiste Perrin, que permitieron determinar el número de Avogadro.
Definición Moderna del Mol: Una Cantidad Específica de Sustancia
En 1960, la definición del mol se estableció formalmente como la cantidad de sustancia de un sistema que contiene tantas entidades elementales como átomos hay en 0,012 kg de carbono 1Esta definición establece que un mol de cualquier sustancia contiene el mismo número de entidades elementales que 0,012 kg de carbono 1
La definición moderna del mol se basa en la constante de Avogadro y permite una cuantificación precisa de la materia, independientemente del tipo de entidad elemental que se considere. El mol se ha convertido en una unidad fundamental en química, utilizada para medir la cantidad de sustancia en reacciones químicas, cálculos estequiométricos y análisis químicos.
Aplicaciones del Mol en Química
El mol tiene un papel crucial en diversos campos de la química, desde la química orgánica hasta la química inorgánica y la bioquímica.
Cálculos Estequiométricos: La Base de las Reacciones Químicas
Los cálculos estequiométricos, que implican la relación entre las cantidades de reactivos y productos en una reacción química, se basan en la unidad del mol. El mol permite determinar la cantidad de reactivos necesarios para obtener una cantidad específica de producto, o viceversa.
Por ejemplo, en la reacción de combustión del metano (CH4) con oxígeno (O2) para producir dióxido de carbono (CO2) y agua (H2O), la ecuación química balanceada es:CH4+ 2O2→ CO2+ 2H2O
Esta ecuación indica que un mol de metano reacciona con dos moles de oxígeno para producir un mol de dióxido de carbono y dos moles de agua. Los cálculos estequiométricos basados en el mol permiten determinar las cantidades exactas de reactivos y productos involucrados en la reacción.
Determinación de la Masa Molar: La Masa de un Mol de Sustancia
La masa molar de una sustancia es la masa de un mol de esa sustancia. Se expresa en gramos por mol (g/mol) y se calcula sumando las masas atómicas de todos los átomos que componen la molécula. Por ejemplo, la masa molar del agua (H2O) es 18 g/mol (1 g/mol por dos átomos de hidrógeno + 16 g/mol por un átomo de oxígeno).
La masa molar es una herramienta fundamental en química, ya que permite convertir entre la cantidad de sustancia en moles y la masa en gramos. Esta conversión es esencial para realizar cálculos estequiométricos y para determinar la concentración de soluciones.
Análisis Químico: Cuantificando la Cantidad de Sustancia
El mol es una unidad fundamental en el análisis químico, donde se utiliza para determinar la cantidad de sustancia presente en una muestra. Los métodos de análisis químico, como la titulación, la espectroscopia y la cromatografía, se basan en el mol para cuantificar las cantidades de sustancias involucradas.
Por ejemplo, en una titulación, se utiliza una solución de concentración conocida (solución estándar) para reaccionar con una muestra de concentración desconocida. La cantidad de sustancia en la muestra se determina a partir del volumen de la solución estándar que se necesita para completar la reacción. La unidad del mol es fundamental para realizar estos cálculos.
La Importancia del Mol en la Química Moderna
El mol es una unidad fundamental en la química moderna, ya que permite una cuantificación precisa de la materia a nivel molecular. Su uso en cálculos estequiométricos, determinación de la masa molar y análisis químico es esencial para el desarrollo de nuevos materiales, la comprensión de procesos químicos y la producción de productos químicos.
El concepto de mol ha revolucionado la química, permitiendo un entendimiento más profundo de las reacciones químicas, la composición de la materia y el comportamiento de los sistemas químicos. Su importancia se extiende a diversos campos, desde la investigación científica hasta la industria química, la medicina y la agricultura.
Sobre el Mol
¿Por qué es importante el mol en química?
El mol es fundamental en química porque permite una cuantificación precisa de la materia a nivel molecular. Esta unidad facilita los cálculos estequiométricos, la determinación de la masa molar y el análisis químico, lo que es esencial para comprender y manipular las reacciones químicas.
¿Cómo se relaciona el mol con la constante de Avogadro?
La constante de Avogadro, NA, representa el número de entidades elementales (átomos, moléculas, iones) que hay en un mol de sustancia. La definición moderna del mol se basa en la constante de Avogadro, estableciendo que un mol de cualquier sustancia contiene el mismo número de entidades elementales que 0,012 kg de carbono 1La constante de Avogadro es un número fundamental en química que permite relacionar la cantidad de sustancia en moles con el número de partículas que la componen.
¿Cómo se utiliza el mol en los cálculos estequiométricos?
Los cálculos estequiométricos, que implican la relación entre las cantidades de reactivos y productos en una reacción química, se basan en la unidad del mol. El mol permite determinar la cantidad de reactivos necesarios para obtener una cantidad específica de producto, o viceversa. Por ejemplo, en la reacción de combustión del metano (CH4) con oxígeno (O2) para producir dióxido de carbono (CO2) y agua (H2O), la ecuación química balanceada es:CH4+ 2O2→ CO2+ 2H2O
Esta ecuación indica que un mol de metano reacciona con dos moles de oxígeno para producir un mol de dióxido de carbono y dos moles de agua. Los cálculos estequiométricos basados en el mol permiten determinar las cantidades exactas de reactivos y productos involucrados en la reacción.
¿Qué es la masa molar y cómo se relaciona con el mol?
La masa molar de una sustancia es la masa de un mol de esa sustancia. Se expresa en gramos por mol (g/mol) y se calcula sumando las masas atómicas de todos los átomos que componen la molécula. Por ejemplo, la masa molar del agua (H2O) es 18 g/mol (1 g/mol por dos átomos de hidrógeno + 16 g/mol por un átomo de oxígeno).
La masa molar es una herramienta fundamental en química, ya que permite convertir entre la cantidad de sustancia en moles y la masa en gramos. Esta conversión es esencial para realizar cálculos estequiométricos y para determinar la concentración de soluciones.
¿Qué es el volumen molar y cómo se relaciona con el mol?
El volumen molar es el volumen que ocupa un mol de una sustancia en condiciones estándar de temperatura y presión (STP). En STP, el volumen molar de un gas ideal es de 22,4 L/mol. El volumen molar es una herramienta útil para determinar el volumen de un gas a partir de su cantidad en moles, o viceversa.
El volumen molar se relaciona con el mol a través de la ley de los gases ideales, que establece que el volumen de un gas ideal es directamente proporcional al número de moles del gas. El volumen molar es una constante que relaciona el volumen y la cantidad de sustancia en moles para un gas ideal.
El mol es una unidad fundamental en química que ha revolucionado la comprensión de la materia. Su definición precisa y su uso en cálculos estequiométricos, la determinación de la masa molar y el análisis químico, han permitido el desarrollo de nuevos materiales, la comprensión de procesos químicos y la producción de productos químicos. El mol es una herramienta esencial para cualquier persona que trabaje en el campo de la química, desde estudiantes hasta investigadores y profesionales de la industria.
Si quieres conocer otros artículos parecidos a El mol: la clave para entender la química puedes visitar la categoría Historias reales.